Blog
Blog

Guía práctica sobre la enfermedad de Glässer
05 de mayo de 20 - Noticias
Carlos Casanovas, Sonia Cárceles, Laura Garza, Salvador Oliver y David Espigares.
Servicio Técnico Porcino. Ceva Salud Animal.
La enfermedad de Glässer está producida por la Haemophillus parasuis (HPS), una bacteria habitual en la microbiota respiratoria del cerdo. La HPS coloniza a muy temprana edad las vías respiratorias altas e infecta al lechón en las primeras semanas de vida, sin causarle necesariamente enfermedad.
Sin embargo, en determinadas circunstancias, esta bacteria es capaz de provocar problemas respiratorios, desmedro y retrasa en el crecimiento a niveles que pueden llegar a ser muy graves. Siempre ha sido un agente que ha causado problemas, pero parece que hoy en día está más descontrolado que nunca, probablemente como consecuencia de la reducción del uso de antibióticos en transiciones.
Factores que condicionan al potencial patógeno de HPS
1. Nivel de patogenicidad de la cepa:
HPS de divide en 15 serovares y se observa una relación entre el tipo de serovar y el grado de virulencia. Por ejemplo, los serovares 1, 5, 10, 12, 13 y 14 se consideran muy virulentos, mientras que 2, 3, 4, 6, 7, 9 y 11 son poco virulentos. Sin embargo, esta clasificación tampoco es totalmente determinante, ya que puede haber ciertas cepas dentro de cada serovar que tengan distinta capacidad patógena en función de los factores de virulencia que presentan. Un factor determinante en el nivel de patogenicidad es la capacidad de escapar a la acción de los macrófagos alveolares, ya que éstos inactivan con mayor eficiencia a las cepas no virulentas que a las virulentas.
2. Interacción con otros agentes infecciosos primarios
HPS tiene el potencial de causar problemas por sí solo, como agente primario. Sin embargo, en la mayoría de ocasiones actúa como agente secundario, ya que necesita de agentes infecciosos primarios, como el PRRS, influenza y el circovirus, que le abran la puerta. Estos virus activan mecanismos inmunodepresores que favorecen las infecciones secundarias. Por ejemplo, el PRRS y, en menor medida, influenza, afectan a los macrófagos pulmonares, lo que puede provocar que cepas poco virulentas que en condiciones normales serían neutralizadas a nivel de pulmón, sean capaces de llegar al torrente sanguíneo. El virus de la influenza genera reacciones inflamatorias y alteraciones en el epitelio pulmonar, que ayudan a que las bacterias se unan al mismo y proliferen con mayor facilidad.
Un estudio realizado por Ovislab demuestra una relación entre la presencia de lesiones en los cornetes nasales y las lesiones de poliserositis causadas, entre otros agentes, por HPS. Ya hemos dicho que HPS es un colonizador habitual de la nariz, por lo que la destrucción de los turbinados nasales facilita su acceso al pulmón. Esta rinitis podría estar causada por agentes infecciosos como Bordetella bronchiseptica, Pasteurella multocida o citomegalovirus y favorecida por factores ambientales (polvo, mala ventilación, exceso de amoníaco…).
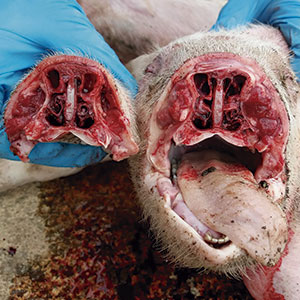
Las lesiones de rinitis abren la puerta a infecciones bacterianas secundarias, como Haemophillus parasuis.
3. Condiciones ambientales deficientes
Las enfermedades de tipo respiratorio siempre son más típicas de las épocas frías porque el estrés térmico suele agravarse por que, en muchas ocasiones, para compensar la falta de temperatura, se compromete la ventilación. La proliferación de gases, la humedad, la falta de oxígeno y la excesiva densidad de animales agravan los cuadros clínicos causados por agentes infecciosos como HPS.
4. Destetes tempranos
La cerda ofrece protección al lechón a través del calostro y la leche, pero la propia inmunidad activa no se genera hasta las 4-5 semanas. Ello provoca que animales destetados con pocos días sean más susceptibles a la infección. Aunque la tendencia actual es a aumentar ligeramente el tiempo de lactación, el aumento de la prolificidad suele generar porcentajes muy elevados de cerdas nodrizas que, cuando se hacen adelantando lechones, rebajan el tiempo de lactación en muchos de ellos.
5. Reducción del uso preventivo de antibióticos
La retirada de antibióticos del pienso, especialmente de amoxicilina, ha incrementado los problemas globales en la fase de transición en algunas granjas y HPS es probablemente uno de los agentes que más se ha aprovechado de esta reducción.
Patogenia, lesiones y síntomas
Una vez llega al pulmón, HPS puede pasar a la sangre y, a partir de ella, a distintas superficies serosas del organismo. Las membranas serosas son envoltorios que recubren los órganos para sujetarlos y evitar fricciones entre ellos. Dichas membranas cubren la cavidad torácica y abdominal, el pulmón (pleura), el corazón (pericardio), las vísceras abdominales (peritoneo), las articulaciones (membranas sinoviales) y el encéfalo (meninges). HPS provoca inflamación de estas superficies serosas (pleuritis, pericarditis, artritis, meningitis), en ocasiones en varias de ellas a la vez (poliserositis), causando lesiones muy características debiado a la presencia de fibrina. Sin embargo, siempre es necesario realizar un correcto diagnóstico diferencial, porque otros agentes como Mycoplasma hyorhinis y Streptococcus suis pueden causar lesiones idénticas.
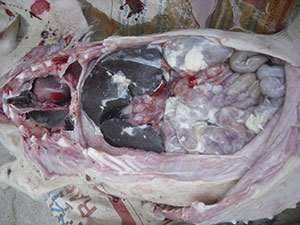
Haemophillus parasuis provoca inflamación serosas causando unas lesiones muy características.
HPS afecta fundamentalmente a animales en la fase de transición, aunque también se han descrito casos en animales adultos, por ejemplo en reemplazos de alto nivel sanitario al entrar en granjas comerciales. El periodo de incubación es de 24 horas a 4-5 días. En casos agudos pueden darse bajas súbitas sin presencia de lesiones típicas en menos de 48 horas. En algunos casos centrados en el sistema nervioso, también es posible que no se observen lesiones claras a nivel macroscópico.
Los animales afectados están apáticos, tienen fiebre (superior a 40 ºC), tos, disnea y secreción nasal. En los casos que afectan a las articulaciones, estas se encuentran inflamadas y a los animales les cuesta levantarse. También puede haber sintomatología nerviosa cuando HPS llega a las meninges. Los animales afectados se van deteriorando progresivamente.
En fases iniciales, el cuadro clínico es muy parecido al de la influenza y, a medida que el animal va degenerando, se va pareciendo más a un cuadro de desmedro causado por PRRS o PCV2. En muchas ocasiones, uno o varios de estos agentes víricos se solapan con la infección por HPS, por lo que el diagnóstico del proceso debe afrontarse a nivel global.
Diagnóstico
HPS es un agente muy lábil, que sobrevive muy poco tiempo tras la muerte del animal, por lo que su aislamiento debe realizarse en bajas muy recientes (mejor en animales sacrificados) y el envío al laboratorio debe ser urgente. El aislamiento es imprescindible para poder realizar antibiogramas pero, a nivel de diagnóstico pueden emplearse PCRs, que tienen la ventaja de ampliar mucho más el margen de detección. HPS es un agente habitual de vías respiratorias altas e incluso puede alcanzar al pulmón sin llegar a provocar cuadros graves. De hecho, es habitual encontrar varios serovares afectando a un mismo animal a nivel de pulmón y no todos serán la causa. Por este motivo su detección a este nivel no es concluyente y siempre debe detectarse a nivel de las membranas serosas, idealmente asociado a lesiones, para obtener un resultado definitivo.
Conclusión
En los últimos años hemos trabajado mucho el diagnóstico de influenza valorando temperaturas en animales, principalmente en transición, y nos ha sorprendido la elevada cantidad de animales que presentan fiebre. En algunos de estos casos el virus de la influenza ya no estaba presente y el proceso febril se prolongaba durante mucho tiempo, afectando a animales con aspecto de estar padeciendo un proceso más bien crónico. Esto hace pensar en la presencia de infecciones bacterianas secundarias, con la implicación bastante probable de agentes infecciosos como HPS.
En la situación actual de reducción de antibióticos, el control de HPS pasa por enfocar el problema de una forma global, tomando medidas frente a agentes primarios como PRRS e influenza, y también frente a las causas que provoquen lesiones de cornetes nasales. También es básico respetar las normas básicas, como la calidad del ambiente, manejo TD-TF, evitar mezclas de edades y orígenes, y combinarlo con un uso racional de tratamientos antibióticos de forma estratégica.






