Blog
Blog

Guia pràctica sobre la malaltia de Glässer
05 de maig de 20 - Noticies
Carlos Casanovas, Sonia Cárceles, Laura Garza, Salvador Oliver i David Espigares.
Servei Tècnic Porcino. Ceva Salud Animal.
La malaltia de Glässer està produïda pel Haemophillus parasuis (HPS), un bacteri habitual en la microbiota respiratòria del porc. L’HPS colonitza des de ben petits les vies respiratòries altes i infecta al garrí durant les seves primeres setmanes de vida, sense causar-li necessàriament la malaltia.
No obstant això, en segons quines circumstàncies, aquest bacteri és capaç de provocar problemes respiratoris importants, decaïment i retard en el creixement a nivells que poden esdevenir molt greus. Sempre ha estat un agent que ha provocat problemes, però sembla que actualment està més descontrolat que mai, probablement a conseqüència de la reducció de l’ús d’antibiòtics en transicions.
Factors que condicionen al potencial patogen d’HPS
1. Nivell de patogenicitat de la cepa:
L’HPS es divideix en 15 serotipus i s’observa una relació entre el tipus de serotipus i el grau de virulència. Per exemple, els serotipus 1, 5, 10, 12, 13 y 14 es consideren molt virulents, mentre que 2, 3, 4, 6, 7, 9 i 11 són poc virulents. Tot i això, aquesta classificació no és totalment determinant, ja que pot haver-hi certes cepes dins de cada serotipus que tinguin una capacitat patògena diferent en funció dels factors de virulència que presentin. Un factor determinant en el nivell de patogenicitat és la capacitat d’escapar a l’acció dels macròfags alveolars, ja que aquests inactiven amb més eficàcia les cepes no virulentes que a les virulentes.
2. Interacció amb altres agents infecciosos primaris
L’HPS té el potencial de provocar problemes per si mateix com a agent primari. No obstant això, la majoria de vegades actua com a agent secundari, ja que necessita agents infecciosos primaris com el PRRS, influença, o el circovirus perquè li obrin la porta.
Aquests virus activen mecanismes immunodepressors que afavoreixen les infeccions secundàries. Per exemple, el PRRS i, a més baix nivell, influença, afecten els macròfags pulmonars, la qual cosa pot provocar que cepes poc virulentes que en condicions normals serien neutralitzades a nivell de pulmó, siguin capaces d’arribar al torrent sanguini. El virus de la influença genera reaccions inflamatòries i alteracions en l’epiteli pulmonar, que ajuden que els bacteris s’uneixin a ell i proliferin amb més facilitat.
Un estudi realitzat per Ovislab mostra una relació entre la presència de lesions en les cornetes nasals i les lesions de poliserositis causades, entre altres agents, per HPS. Ja hem dit que HPS és un colonitzador habitual, per la qual cosa la destrucció dels turbinats nasals facilita el seu accés al pulmó. Aquesta rinitis podria ser causada per agents infecciosos com Bordetella bronchiseptica, Pasteurella multocida o citomegalovirus i afavorida per factors ambientals (pols, mala ventilació, excés d’amoníac...).
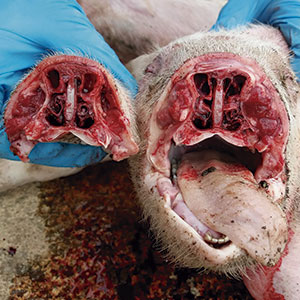
Les lesions de rinitis obren la porta a infeccions bacterianes secundàries, com Haemophillus parasuis.
3. Condicions ambientals deficients
Les malalties del tipus respiratori sempre són més típiques de les èpoques fredes perquè l’estrès tèrmic s’acostuma a agreujar perquè, en moltes ocasions, per compensar la manca de temperatura, es compromet la ventilació. La proliferació de gasos, la humitat, la manca d’oxigen i l’excessiva densitat d’animals agreugen els quadres clínics causats per agents infecciosos com l’HPS.
4. Deslletaments primerencs
La truja ofereix protecció al garrí a través del calostre i la llet, però la pròpia immunitat activa no es genera fins a les 4 – 5 setmanes. Això provoca que animals deslletats amb pocs dies siguin més susceptibles a la infecció. Encara que la tendència actual és augmentar lleugerament el temps de lactació, l’augment de la prolificitat acostuma a generar percentatges molt elevats de truges nodrisses que, quan es fan avançant garrins, rebaixen el temps de lactació en molts d’ells.
5. Reducció de l’ús preventiu d’antibiòtics
La retirada d’antibiòtics del pinso, especialment d’amoxicil·lina, ha incrementat els problemes globals en la fase de transició en algunes granges. L’HPS és probablement un dels agents que més s’ha aprofitat d’aquesta reducció.
Patogènia, lesions i símptomes
Un cop arriba al pulmó, l’HPS pot passar a la sang i, a partir d’ella, a diverses superfícies seroses de l’organisme. Les membranes seroses són embolcalls que cobreixen els òrgans per subjectar-los i evitar friccions entre ells. Aquestes membranes cobreixen la cavitat toràcica i abdominal, el pulmó (pleura), el cor (pericardi), les vísceres abdominals (peritoneu), les articulacions (membranes sinovials) i l’encèfal (meninges). L’HPS provoca la inflamació d’aquestes superfícies seroses (pleuritis, pericarditis, artritis, meningitis), en ocasions en vàries d’elles a la vegada (poliserositis), causant unes lesions molt característiques per la presència de fibrina. No obstant això, sempre és necessari realitzar un diagnòstic diferencial correcte, perquè altres agents com Mycoplasma hyorhinis y Streptococcus suis poden causar lesions idèntiques.
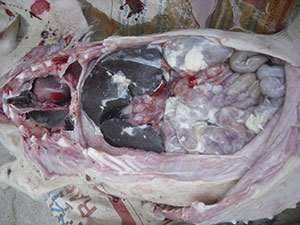
Haemophillus parasuis provoca inflamació seroses causant unes lesions molt característiques.
L’HPS afecta fonamentalment a animals en fase de transició, encara que també s’han descrit casos en animals adults, per exemple, en reemplaçaments d’alt nivell sanitari en entrar en granges comercials. El període d’incubació és de 24 hores a 4-5 dies. En casos aguts poden donar-se baixes sobtades sense presència de lesions típiques en menys de 48 hores. En alguns casos centrats en el sistema nerviós, també és possible que no s’observin lesions clares a nivell macroscòpic. Els animals afectats estan apàtics, tenen febre (superior a 40ºC), tos, dispnea i secreció nasal. En els casos que afecten les articulacions, aquestes es troben inflamades i als animals els costa alçar-se. També pot haver simptomatologia nerviosa quan l’HPS arriba a les meninges. Els animals afectats es van deteriorant progressivament.
En fases inicials, el quadre clínic és molt semblant al de la influença i, a mesura que l’animal degenera, es va assimilant més a un quadre de decaïment causat per PRRS o PCV2. Moltes vegades, un o varis d’aquests agents es solapen amb la infecció per HPS, per la qual cosa el diagnòstic del procés s’ha d’encarar a nivell global.
Diagnòstic
L’HPS és un agent molt làbil, que sobreviu poc temps després de la mort de l’animal, per la qual cosa el seu aïllament s’ha de fer en baixes molt recents (millor en animals sacrificats) i l’enviament al laboratori ha de ser urgent. L’aïllament és imprescindible per poder realitzar antibiogrames però, a nivell de diagnòstic podem utilitzar-se PCRs, que tenen l’avantatge d’ampliar més el marge de detecció. L’HPS és un agent habitual de les vies respiratòries altes i inclús pot arribar al pulmó sense arribar a provocar quadres greus. De fet, és habitual trobar diversos serotipus afectant un mateix animal a nivell de pulmó i no tots en seran la causa. Per aquest motiu, la detecció a aquest nivell no és concloent i sempre ha de detectar-se a nivell de les membranes seroses, idealment associat a lesions, per obtenir un resultat definitiu.
Conclusió
En els darrers anys hem treballat molt en el diagnòstic d’influença valorant temperatures en animals, principalment en transició, i ens ha sorprès l’elevada quantitat d’animals que presenten febre. En alguns el virus de la influença ja no estava present i el procés febril es perllongava durant molt temps, afectant animals amb aspecte d’estar patint un procés més aviat crònic. Això fa pensar en la presència d’infeccions bacterianes secundàries, amb la implicació força probable d’agents infecciosos com HPS.
Amb la situació actual de reducció d’antibiòtics, el control d’HPS passa per enfocar el problema d’una forma global, prenent mesures enfront d’agents primaris com el PRRS o influença. També és bàsic respectar les normes bàsiques com la qualitat de l’ambient, el maneig TD-TF, evitar barreges d’edats i orígens, i combinar-ho amb un ús racional de tractaments antibiòtics de forma estratègica.






